Uno studio di ricercatori italiani del CNR-IBPM e della Sapienza, Università di Roma, pubblicato sulla rivista Nature Structural and Molecular Biology, ha permesso di offrire una caratterizzazione strutturale di un intermedio "misfolded". Il lavoro scientifico descrive la prima struttura di uno stato "misfolded" e rappresenta il primo passo verso la comprensione della cascata del "misfolding", la causa di molte patologie nell'uomo.
Gli stati non correttamente ripiegati che si possono popolare durante il "folding" delle proteine sono potenzialmente soggetti a fenomeni di aggregazione e sono stati collegati a diverse patologie quali il morbo di Alzheimer e di Parkinson. A dispetto della loro importanza, a causa del loro carattere transiente, tali intermedi sono stati scarsamente studiati da un punto di vista strutturale.
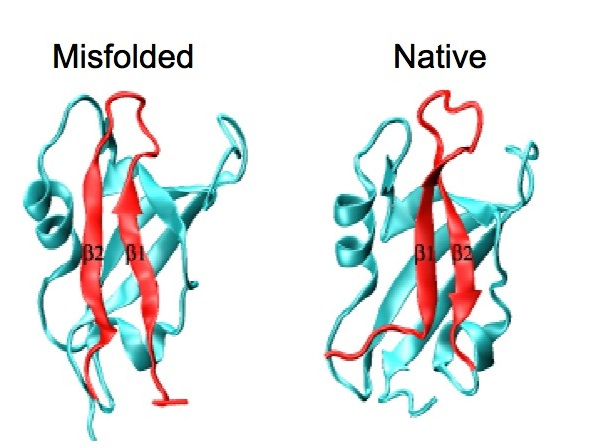
Attraverso lo studio del meccanismo di "folding" di un semplice sistema modello, la famiglia dei domini PDZ, Stefano Gianni, Maurizio Brunori e colleghi, in collaborazione con il Professor Michele Vendruscolo dell'Università di Cambridge (Regno Unito), hanno offerto la prima descrizione strutturale di uno stato "misfolded". Sorprendentemente, l'intermedio è caratterizzato da una struttura in larga parte di tipo nativo, con piccoli difetti di "folding" principalmente localizzati nel sito attivo della proteina. Questo risultato suggerisce pertanto che stabilità e funzione possono porre vincoli contrastanti sulla stabilità delle proteine.
Questo lavoro scientifico rappresenta un passo importante nella comprensione di molte malattie neurodegenerative, ed apre nuove prospettive nella cura di tali patologie mediante la stabilizzazione dello stato nativo delle proteine.
Vedi anche:
Immagini: